Рецензенты:
д.ф.-м.н. ШУЛЬГА Сергей Михайлович;
д.б.н. БОЖОК Галина Анатольевна
Соколик В.В., Кушелев А.Ю.
С 54 Геометрия живого наномира. Пикотехнология белков / В.В. Соколик, А.Ю. Кушелев. – Харьков: Издательство, 2015. – 255 с.
ISBN 978-3-659-92862-8
Монография посвящена 3D-структуре молекул и полимеров живых систем. Дан анализ современного понимания таких фундаментальных понятий, как физический объём атома, химическая связь, генетический код. На основе статистического анализа экспериментальных данных о структуре белка обосновано кодирование его вторичной структуры и структурного полипептидного шаблона в геноме. Предложена дополненная таблица генетического кода белков и пептидов, которая легла в основу геометрического алгоритма программ декодирования структурного шаблона белка Molecular Constructor и Picotech. Сформулирована гипотеза о перекодировании информации третьего нуклеотида кодона в соответствующий ротамер пептидной связи непосредственно 3D-структурой изоакцепторной тРНК. Математический анализ сопряженности значений углов φ и ψ (карта Рамачандрана) выявил периодичность их изменения, что позволило обосновать механизм посттрансляционного фолдинга белка.
Книга рассчитана на специалистов, занимающихся исследованиями в области молекулярной биологии, биоинформатики, биохимии, биофизики.
Табл.: 36 . Ил.:117 . Библиогр.: 227 назв.
Sokolik VV, Kushelev AY
Geometry live nanoworld. Pikotechnology proteins / VV Sokolik, AY Kushelev. - Kharkov: Publishing, 2015. – 255 p.
ISBN 978-3-659-92862-8
The monograph is devoted to the 3D-structure of molecules and polymers in living systems. The analysis of the modern understanding of the fundamental concepts of the physical volume of the atom, chemical bonding, and the genetic code is presented. Based on statistical analysis of the experimental data on the protein structure is justified coding secondary structure and structural polypeptide template of protein in the genome. Propose additions table of the genetic code of proteins and peptides, which formed the basis of the geometric algorithm software decoding structural template protein, are Molecular Constructor and Picotex. The hypothesis of recoding information to third nucleotide codon in the corresponding peptide bond rotamer directly 3D-structure isoacceptors tRNA is formulated. Mathematical analysis of contingency angles φ and ψ (Ramachandran map) revealed their frequency changes as possible to substantiate the mechanism of post-translational protein folding.
The book is intended for professionals involved in research in the field of molecular biology, bioinformatics, biochemistry and biophysics.
Table: 36. Ill: 117. Refs: 227 titles.
ПРЕДИСЛОВИЕ РЕЦЕНЗЕНТОВ
В 21-м столетии в задаче моделирования нанообъектов таких как атом углерода, органические молекулы, пары комплементарных нуклеотидов и многих других используется кольцегранная модель строения атома. В монографии В.В. Соколик и А.Ю. Кушелева «Геометрия живого наномира. Пикотехнология белков» при помощи кольцегранного подхода к строению атома наглядно (образ – модель) реализуются различные виды, свойства и особенности межатомных взаимодействий, валентные углы в молекулах, разновидности химических связей и их соотношение. Кольцегранная модель реалистично объясняет гибридизацию электронов при формировании химических связей в молекулах, что является краеугольным камнем всей биохимии белкового мира, поскольку атомы углерода в состоянии sp3-гибридизации своих электронов входят в состав скелета аминокислот и таким способом детерминируют углы между химическими связями в их молекулах, а в последующем и в структуре белка в целом.
В монографии В.В. Соколик и А.Ю. Кушелева «Геометрия живого наномира. Пикотехнология белков» сформулирована идея композиционного генетического кода, кодирования ротамерии пептидной связи и структурного шаблона белка. Показано, что в геноме третьим нуклеотидом кодона детерминирован один из трёх ротамерных вариантов пептидной связи, которым аминокислотный остаток (закодированный дуплетом первых двух нуклеотидом кодона) присоединяется к растущей полипептидной цепи. Ротамерный вариант пептидной связи реализуется в процессе синтеза белка в рибосоме и поэтому с неё сходит индивидуальный структурный шаблон белка в соответствие с информацией, содержащейся в его гене. Данный механизм трансляции генетической информации является эволюционно новым. Его формирование у эукариот было обусловлено необходимостью синтеза больших и сложных белков в виде структурного шаблона, максимально приближенного к функциональной конформации этих белков, чтобы их фолдинг имел наибольшие эффективность и однозначность. У прокариот и органелл эукариот третий нуклеотид кодонов в генах небольших полипептидов ещё не является информационным, поэтому на нём и наблюдается воблирование.
Выше изложенные положения легли в основу алгоритма авторских компьютерных программ, которые по нуклеотидной последовательности мРНК позволяют смоделировать схему вторичной структуры и 3D-структуру индивидуального структурного шаблон любого белка. Эту первичную информацию о белке можно использовать в дальнейшем моделировании фолдинга функциональной конформации белка с учетом физ-химии его микроокружения, посттрансляционных модификаций, взаимодействия с лигандами методами молекулярной динамики и доккинга наравне с информацией о наиболее стабильном конформере, которую извлекают из рентгенограмм кристаллов белков. Преимущество данного подхода состоит в возможности быстрого моделирования индивидуальной пространственной структуры отдельной молекулы любого белка с точностью до электрона (пикотехнология), опираясь лишь на информацию о нём в геноме. То есть in silico воспроизводится трансляция генетической информации в индивидуальный структурный шаблон белка. Не исключено, что большинство белков именно из конформации своего структурного шаблона максимально быстро, а главное однозначно, фолдируют в нативную конформацию с минимумом свободной энергии, формиру таким образом «устойчивое большинство» конформационно лабильного белкового пула.
Авторами монографии предложен современный, точный и удобный методологический подход в арсенале молекулярной биологии для моделирования пространственной структуры белков, исходя из той информации генома о них, которой располагает сама клетка.
Итак, перед читателем книга, вводящая в мир идей и результатов, ориентированных на применение в протеомике кольцегранной модели и молекулярный полиморфизм, основанный на структурном разнообразии биомакромолекул. В этой области причудливым и невероятным образом пересекаются достижения многих областей современной науки: физики и химии, биологии и медицины, математики и информатики.
Доктор физико-математических наук С.М. Шульга
В настоящее время моделирование пептидов и белков относится к современным и востребованным методическим подходам, позволяющим не только дополнять, но и порой с успехом заменять условно гуманные эксперименты на лабораторных животных, касающиеся взаимодействия различных биогенных соединений с клеточными структурами. К сожалению, данными подходами владеют немногие естествоиспытатели, успешно работающие в своих областях наук. И в этом случае монография В.В. Соколик и А.Ю. Кушелева «Геометрия живого наномира. Пикотехнология белков» позволяет если не овладеть, то, по крайней мере, понять суть применяемых авторами методов построения моделей белков и их кодирования в геноме. Тем более, что книга очень увлекательно и доступно написана. Достигается эта легкость понимания материала тем, что в монографии четко прослеживается научная логика рассуждений и методических подходов авторов. Читателя знакомят с развитием теории строения атома, как с традиционными уже исторически устоявшимися сведениями, так и с новыми интерпретациями кольцегранной структуры атома и аппроксимации геометрии кольцегранной электронной оболочки архимедовыми телами. Авторы пользуются новой «системой координат», их пикотехнология – это технология электронного уровня, разрешение и точность которой сопоставимы с толщиной закольцованного луча-электрона (пикометр – 10-12 м) в атомах белка. Именно этот подход лежит в основе разработанного авторами геометрического алгоритма определения атомного радиуса.
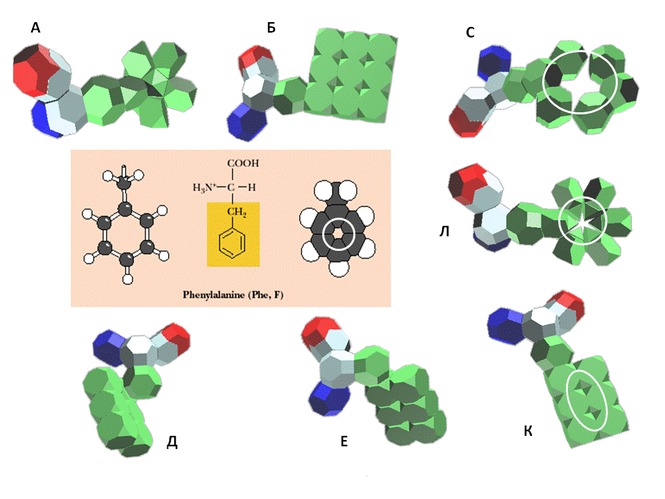
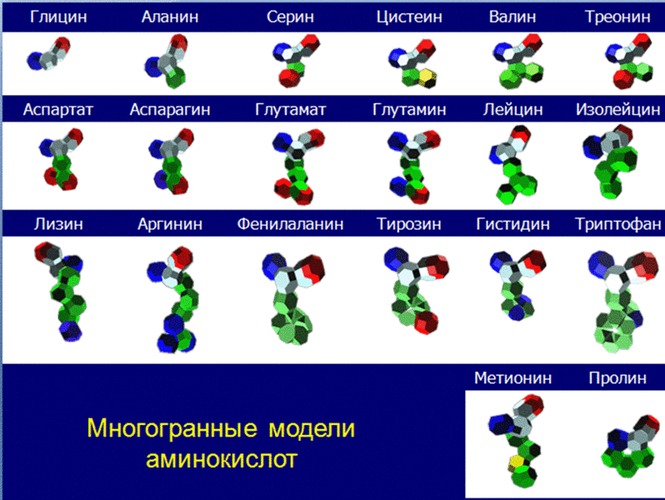
Одним из важнейших итогов материала монографии В.В. Соколик и А.Ю. Кушелева является реальная возможность с помощью законов геометрии макромира рассчитывать положения атомов в молекуле, не прибегая к квантово-механическим функциям. Такие перспективы обеспечиваются ещё и закономерностями формообразования молекул, которые определены структурой внешних кольцегранных оболочек их атомов, которая, как показано авторами, типична для элементов каждой группы таблицы Менделеева. Сопоставление в монографии экспериментальных данных с представленными моделями протеиногенных аминокислот, рассчитанными геометрическим способом для шаблона многогранных моделей аминокислот, аргументирует убедительность и логичность методологии авторов. Кроме моделей самих аминокислот авторы уточняют способ объединения их в полипептидах, возможность формирования трех видов ротамеров пептидной связи (R, 0 или L-ротамеров), которые интерпретируются авторами в качестве прототипов соответствующих конформеров вторичной структуры в белках.
Через призму теории формирования внешней электронной кольцегранной оболочки атома авторы рассматривают последовательно весь геометрический процесс построения пептидов – от пространственной структуры аминокислот до вторичной конформации и этапов фолдинга белковой молекулы. Логичным фрагментом исследований, изложенных в монографии, является объяснение способа и механизма кодирования и декодирования информации о структурном шаблоне белка в геноме.
Детально охарактеризованы декодированные в программах Molecular Constructor и Picotech В.В. Соколик и А.Ю. Кушелева структурные шаблоны белков в качестве субъектов последующего фолдинга. Представлен количественный сравнительный анализ декодированных структур с соответствующими экспериментальными моделями из базы данных PDB. Особое внимание уделено способам описания пространственной структуры белка и характеристике элементов вторичной структуры, а также современным методам моделирования in silico.
Следует отметить, что данная монография актуальна не только как научный труд. Собственный интерес авторов к своей работе заражает, более чем полный массивный объем информации, увлекательная и яркая форма ее изложения и оформления делает монографию применимой также и в качестве учебника для студентов естественнонаучных специальностей, особенно таких, как биохимия, биофизика и биотехнология.
Доктор биологических наук Г.А.Божок





The greatest enemy of knowledge is not ignorance, it is the illusion
Stephen Hawking
Sokolik VV, Kushelev AY
Geometry live nanoworld. Pikotechnology proteins / VV Sokolik, AY Kushelev. - Kharkov: Publishing, 2015. – 358 p.
The monograph is devoted to the 3D-structure of molecules and polymers in living systems. The analysis of the modern understanding of the fundamental concepts of the physical volume of the atom, chemical bonding, and the genetic code is presented. Based on statistical analysis of the experimental data on the protein structure is justified coding secondary structure and structural polypeptide template of protein in the genome. Propose additions table of the genetic code of proteins and peptides, which formed the basis of the geometric algorithm software decoding structural template protein, are Molecular Constructor and Picotex. The hypothesis of recoding information to third nucleotide codon in the corresponding peptide bond rotamer directly 3D-structure isoacceptors tRNA is formulated. Mathematical analysis of contingency angles φ and ψ (Ramachandran map) revealed their frequency changes as possible to substantiate the mechanism of post-translational protein folding.
The book is intended for professionals involved in research in the field of molecular biology, bioinformatics, biochemistry and biophysics.
Table: 36. Ill: 117. Refs: 227 titles.
ПРЕДИСЛОВИЕ РЕЦЕНЗЕНТОВ
В 21-м столетии в задаче моделирования нанообъектов таких как, атом углерода, органические молекулы, пары комплементарных нуклеотидов и многих других используется кольцегранная модель строения атома. В монографии В.В. Соколик и А.Ю. Кушелева «Геометрия живого наномира. Пикотехнология белков» при помощи кольцегранного подхода к строению атома наглядно (образ – модель) реализуются различные виды, свойства и особенности межатомных взаимодействий, валентные углы в молекулах, разновидности химических связей и их соотношение. Кольцегранная модель реалистично объясняет гибридизацию электронов при формировании химических связей в молекулах, что является краеугольным камнем всей биохимии белкового мира, поскольку атомы углерода в состоянии sp3-гибридизации своих электронов входят в состав скелета аминокислот и таким способом детерминируют углы между химическими связями в их молекулах, а в последующем и в структуре белка в целом.
В монографии В.В. Соколик и А.Ю. Кушелева «Геометрия живого наномира. Пикотехнология белков» сформулирована идея композиционного генетического кода, кодирования ротамерии пептидной связи и структурного шаблона белка. Показано, что в геноме третьим нуклеотидом кодона детерминирован один из трёх ротамерных вариантов пептидной связи, которым аминокислотный остаток (закодированный дуплетом первых двух нуклеотидом кодона) присоединяется к растущей полипептидной цепи. Ротамерный вариант пептидной связи реализуется в процессе синтеза белка в рибосоме и поэтому с неё сходит индивидуальный структурный шаблон белка в соответствие с информацией, содержащейся в его гене. Данный механизм трансляции генетической информации является эволюционно новым. Его формирование у эукариот было обусловлено необходимостью синтеза больших и сложных белков в виде структурного шаблона, максимально приближенного к функциональной конформации этих белков, чтобы их фолдинг имел наибольшие эффективность и однозначность. У прокариот и органелл эукариот третий нуклеотид кодонов в генах небольших полипептидов ещё не является информационным, поэтому на нём и наблюдается воблирование.
Выше изложенные положения легли в основу алгоритма авторских компьютерных программ, которые по нуклеотидной последовательности мРНК позволяют смоделировать схему вторичной структуры и 3D-структуру индивидуального структурного шаблон любого белка. Эту первичную информацию о белке можно использовать в дальнейшем моделировании фолдинга функциональной конформации белка с учетом физ-химии его микроокружения, посттрансляционных модификаций, взаимодействия с лигандами методами молекулярной динамики и доккинга наравне с информацией о наиболее стабильном конформере, которую извлекают из рентгенограмм кристаллов белков. Преимущество данного подхода состоит в возможности быстрого моделирования индивидуальной пространственной структуры отдельной молекулы любого белка с точностью до электрона (пикотехнология), опираясь лишь на информацию о нём в геноме. То есть, in silico воспроизводится трансляция генетической информации в индивидуальный структурный шаблон белка. Не исключено, что большинство белков именно из конформации своего структурного шаблона максимально быстро, а главное однозначно, фолдируют в нативную конформацию с минимумом свободной энергии, формируя, таким образом, «устойчивое большинство» конформационно лабильного белкового пула.
Авторами монографии предложен современный, точный и удобный методологический подход в арсенале молекулярной биологии для моделирования пространственной структуры белков, исходя из той информации генома о них, которой располагает сама клетка.
Итак, перед читателем книга, вводящая в мир идей и результатов, ориентированных на применение в протеомике кольцегранной модели и молекулярный полиморфизм, основанный на структурном разнообразии биомак-ромолекул. В этой области причудливым и невероятным образом пересекаются достижения многих областей современной науки: физики и химии, биологии и медицины, математики и информатики.
Доктор физико-математических наук С.М. Шульга
В настоящее время моделирование пептидов и белков относится к современным и востребованным методическим подходам, позволяющим не только дополнять, но и порой с успехом заменять условно гуманные эксперименты на лабораторных животных, касающиеся взаимодействия различных биогенных соединений с клеточными структурами. К сожалению, дан-ными подходами владеют не многие естествоиспытатели, успешно работающие в своих областях наук. И в этом случае монография В.В. Соколик и А.Ю. Кушелева «Геометрия живого наномира. Пикотехнология белков» позволяет если не овладеть, то, по крайней мере, понять суть применяемых авторами методов построения моделей белков и их кодирования в геноме. Тем более, что книга очень увлекательно и доступно написана. Достигается эта легкость понимания материала тем, что в монографии четко прослеживается научная логика рассуждений и методических подходов авторов. Читателя знакомят с развитием теории строения атома, как с традиционными уже исторически устоявшимися сведениями, так и с новыми интерпретациями кольцегранной структуры атома и аппроксимации геометрии кольцегранной электронной оболочки архимедовыми телами. Авторы пользуются новой «системой координат», их пикотехнология – это технология электронного уровня, разрешение и точность которой сопоставимы с толщиной закольцованного луча-электрона (пикометр – 10-12 м) в атомах белка. Именно этот подход лежит в основе разработанного авторами геометрического алгоритма определения атомного радиуса.
Одним из важнейших итогов материала монографии В.В. Соколик и А.Ю. Кушелева является реальная возможность с помощью законов геометрии макромира рассчитывать положения атомов в молекуле, не прибегая к квантово-механическим функциям. Такие перспективы обеспечиваются ещё и закономерностями формообразования молекул, которые определены структурой внешних кольцегранных оболочек их атомов, которая, как показано авторами, типична для элементов каждой группы таблицы Менделеева. Сопоставление в монографии экспериментальных данных с представленными моделями протеиногенных аминокислот, рассчитанными геометрическим способом для шаблона многогранных моделей аминокислот, аргументирует убедительность и логичность методологии авторов. Кроме моделей самих аминокислот, авторы уточняют способ объединения их в полипептидах, возможность формирования трех видов ротамеров пептидной связи (R, 0 или L-ротамеров), которые интерпретируются авторами в качестве прототипов соответствующих конформеров вторичной структуры в белках.
Через призму теории формирования внешней электронной кольцегранной оболочки атома авторы рассматривают последовательно весь геометрический процесс построения пептидов – от пространственной структуры аминокислот до вторичной конформации и этапов фолдинга белковой молекулы. Логичным фрагментом исследований, изложенных в монографии, является объяснение способа и механизма кодирования и декодирования информации о структурном шаблоне белка в геноме.
Детально охарактеризованы декодированные в программах Molecular Constructor и Picotech В.В. Соколик и А.Ю. Кушелева структурные шаблоны белков в качестве субъектов последующего фолдинга. Представлен количественный сравнительный анализ декодированных структур с соответствующими экспериментальными моделями из базы данных PDB. Особое внимание уделено способам описания пространственной структуры белка и характеристике элементов вторичной структуры, а также современным методам моделирования in silico.
Следует отметить, что данная монография актуальна не только как научный труд. Собственный интерес авторов к своей работе заражает, более чем полный массивный объем информации, увлекательная и яркая форма ее изложения и оформления делает монографию применимой также и в качестве учебника для студентов естественнонаучных специальностей, особенно таких, как биохимия, биофизика и биотехнология.
Доктор биологических наук Г.А.Божок
ПРЕДИСЛОВИЕ АВТОРОВ
Главная цель, которую поставили перед собой авторы этой книги, это задействование возможностей и закономерностей пространственной геометрии атомов, точнее, их электронных оболочек, в построении моделей белков.
Почему пикотехнология белков? Мир, с которым мы привыкли иметь дело в обиходе, называют макромиром, базовой единицей измерения которого является метр (м). В конце XIX века был обнаружен микромир, харак-терным размером которого являются габариты атома – ангстрем (1Å – 10-10 м). На базе законов микромира создавалась современная нанотехнология (10-9 м). Еще раньше был открыт мегамир, порядок величин в котором – размер галактик (30 парсек – 1015 м). Поскольку эти миры имеют граничные размеры, значит, за их пределами лежат другие миры, с иным характерным размером, на несколько порядков меньше ангстрема и больше парсека. Пи-котехнология – это технология электронного уровня, разрешение и точность которой сопоставимы с толщиной закольцованного луча-электрона (пико-метр – 10-12 м) в атомах белка.
Читатель, который не намерен сразу вникать в физический смысл кольцегранной модели атома и химическое обоснование ротамерии пептидной связи, может пропустить первые две главы книги и начинать с принципов декодирования структурного шаблона белка по детерминирующей его нуклеотидной последовательности, а затем из любопытства вернуться к пропущенному.
Мы не включили в данную книгу разделы о структуре ядра атома и взаимодействии нуклонов, а также большой материал о конформационной подвижности белковых молекул в зависимости от микроокружения. Такое ограничение обусловлено тем, что в геноме детерминированы, прежде всего, уникальные структурные шаблоны белков, трансляция которых в ходе матричного синтеза определяет геометрию электронных поверхностей новосинтезированных белков независимо от микроокружения. Кроме этого, мы, по примеру выдающегося физика-астролога Стивена Хокинга, стремились избегать любых формул.
Авторы выражают благодарность друзьям и коллегам за обсуждение монографии и рады любым замечаниям, которые помогут её усовершенствовать.
В.В. Соколик, А.Ю. Кушелев
***
ВВЕДЕНИЕ
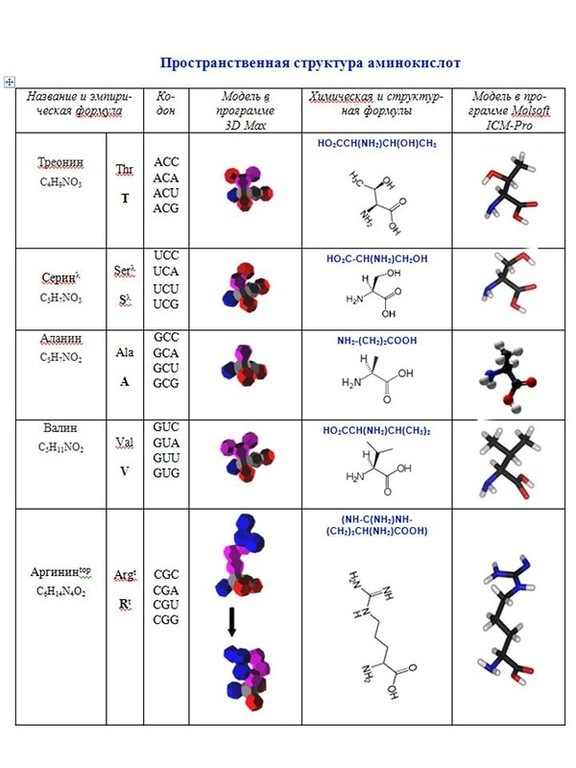
Общая схема построения монографии подчинена логике: «структура общего определяется упорядоченной структурой всех его компонентов». Руководствуясь этой установкой, в 1 главе представлены обоснования и новые интерпретации кольцегранной структуры атома, аппроксимация его физического объёма и геометрии кольцегранной электронной оболочки архимедовыми телами, а также приведен, разработанный авторами, геометрический алгоритм определения атомного радиуса. Во 2 главе выполнен анализ представлений о химической связи и гибридизации электронных орбиталей с позиций перекрывания не электронных плотностей, а вакантных мест во внешней кольцегранной электронной оболочке атомов при формировании молекул из них. С этих позиций охарактеризованы атомы элементов таблицы Менделеева. В 3 главе рассмотрен разработанный и реализованный в программе Molecular Сonstructor (МС) геометрический алгоритм расчета координат центров атомов в моделях протеиногенных аминокислот. Введены понятия ротамерии пептидной связи между аминокислотными остатками и структурного полипептидного шаблона белка. Результаты модельных экспериментов показали, что повторение R, 0 или L-ротамеров пептидной связи обусловливает формирование правых, левых (поворотов) и β-спиралей. Мы их интерпретируем в качестве прототипов соответствующих конформеров вторичной структуры в белках. 4 глава посвящена способу кодирования и механизму декодирования информации о структурном шаблоне белка в геноме. А именно приведен статистический анализ экспериментальных данных в пользу специфического детерминирования в геноме конформеров вторичной структуры и шаблона пространственной структуры белка, согласно предложенной таблице генетического кода структурного шаблона белка. Обсуждается заявленная гипотеза о перекодировании информации третьего нуклеотида кодонов в ротамер пептидной связи непосредственно 3D-структурой изоакцепторных адапторных РНК к синонимичным кодонам. В последней 5 главе кратко изложены современные представления о фолдинге белка и охарактеризованы структурные шаблоны 100 белков из базы PDB, декодированные в программах Molecular Constructor и Picotech.
Стр 110-111
Стр. 146-147
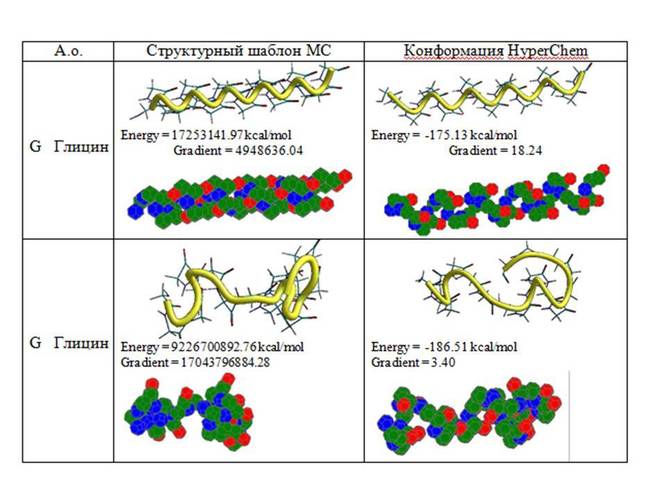
НОВИЗНА ИДЕЙ ИЛИ ПОСЛЕСЛОВИЕ
1. Впервые продемонстрирован алгоритм моделирования 3D-геометрии атомов и молекул на основе кольцегранной модели атома и её апроксимации телами Архимеда. Представлен метод расчета атомных радиусов атомов элементов таблицы Менделеева исходя из экспериментальных значений их ковалентных радиусов с учётом геометрии электронной поверхности.
2. Заново переосмыслено понятие химической связи: перекрывание вакантных мест (а не электронной плотности) внешних электронных кольцегранных оболочек взаимодействующих атомов, что приводит к их реальному сближению и снижению электронной плотности между атомами в молекуле, сопровождающееся уменьшением общей энергии системы и напряжения в ней.
3. Введено понятие о R (right)-, 0 (zero)- и L (left)-ротамеров пептидной связи, которые различаются между собой поворотом на угол кратный 120о.
4. Статистически обосновано кодирование ротамеров пептидной связи, фрагментов вторичной структуры и структурных шаблонов белков в целом в геноме эукариот. Представлена таблица генетического кода структурного шаблона белка.
5. Сформулирована гипотеза о перекодировании информации третьего нуклеотида кодонов в соответствующий ротамер пептидной связи непосредственно самой 3D-структурой изоакцепторной тРНК, а точнее углом поворота её акцепторного стебля вокруг своей оси.
6. Математический анализ сопряженности значений углов φ и ψ (карта Рамачандрана) для вторичных структур позволил обнаружить период их изменения в 120о при переходе от одной вторичной структуры к другой и предложить возможный механизм посттрансляционного фолдинга белка.
7. Разработаны две авторские программы декодирования структурного шаблона белка Molecular Constructor и Picotech.
АВТОРСКИЕ ПУБЛИКАЦИИ
1. Соколик В.В. Кодирование вторичной структуры и структурного шаблона белка в геноме эукариот / НАУЧНЫЙ ФОНД "БИОЛОГ", Ежемесячный научный журнал. – 2014. – № 3. – С. 73-76.
2. Соколик В.В. Никакой дополнительной информации, большей, чем та, что содержится в ДНК, для сворачивания белка не требуется / Ukr. Biochem. J., 2014. – 86, 5 (Suppl. 1) Матеріали ХІ Укріїнського біохімічного конгресу (06-10 жовтня 2014), Київ, c. 37-38.
3. Соколик В.В. Предсказание пространственной структуры белка in silico на основе информации генома и геометрического алгоритма – альтернатива квантово-механическому подходу / Материалы Международной научной конференции «Математическое и компьютерное моделирование в биологии и химии. Перспективы развития» (28-30 мая 2012), Казань. – 2012. – С.155-158.
4. Соколик В.В. Геометрия аминокислот / Материалы XV Международной научно-практической конференции «Наука и современность – 2012» (НС-15), (14 марта 2012), Новосибирск. – 2012. – С. 13-18.
5. Кушелев А.Ю., Соколик В.В. Пикотехнология – новый подход в моделировании пространственной структуры белка / Заочная Международная научно-практическая конференция «Современная наука: тенденции развития» (24 января 2012), Краснодар: НИЦ Априори. – 2012. – С.203-207.
6. Соколик В.В. Загадка изоакцепторных тРНК / Материалы II Всероссийской Интернет-Конференции «Актуальные проблемы биохимии и бионанотехнологии» (15-18 ноября 2011), Казань, Россия. – С. 11-15.
7. Соколик В.В. Кодирование торсинного угла ω пептидной связи в белке / IV Международная конфер. "Актуальные проблемы биологии, нанотехнологий и медицины". (22-25 сентября 2011), Ростов-на-Дону. – С. 60-61.
8. Sokolik V.V. Protein is coded in genome and synthesized in ribosomes as a structural template of a rotameric version sequence of peptide bound configuration / The International Moscow Conference on Computational Molecular Biology, МССМВ-11 (July 21-24, 2011), Moscow, Russia. – P. 347-348.
9. Соколик В.В. Карта Рамачандрана: ротамерия пептидной связи и фолдинг белка / Материалы VII Международной научно-технической конференции «Актуальні питання біологічної фізики і хімії». Тезисы докладов БФФХ-2011 (26-30 апреля 2011 г.), Севастополь.– С.137-139.
10. Sokolik V.V. Algorithm of protein structural template decoding according to its determined nucleotide sequence / Fist International Conference “Fundamental Medicine: From Scalpel Toward Genome, Proteome and Lipidome” (April 25-28, 2011), Pax Grid Virtual Conferences, Kazan, Russia. – P. 117-119.
11. Соколик В.В. Ротамерные варианты конфигурации пептидной связи и их кодирование в геноме / Матеріали X Українського біохімічного з’їзду. Тези доповідей (13—17 вересня 2010 р.), Одеса. – С. 105-106.
12. Соколик В.В. Способ моделирования пространственной структуры белка по детерминирующей его нуклеотидной последовательности // Біофізичний вісник. – 2010. - Вип. 24 (1). – С. 31-45.
13. Sokolik V.V. Modeling of the individual structural template of protein on determining it nucleotide sequences / Материалы VII Международной конференции по биоинформатике, регуляции и структуры геномов и системной биологии (BGRS\SB-2010). Тезисы докладов (20-27 июня 2010 г.), Новосибирск. – С. 275.
14. Соколик В.В. Пространственная структура гомологов основного актина и α-актина 1 различна / Сборник материалов I Международной научно-практической конференции «Наука и современность – 2010» в 3-х частях / Под общ. ред. С.С. Чернова - Новосибирск: «СИБПРИНТ», 2010. – 278 с. Ч. 1, С. 41-46.
15. Соколик В.В. Моделирование пространственной структуры белка по детерминирующей его нуклеотидной последовательности / Материалы VI Международной научно-технической конференции «Актуальні питання теоретичної і прикладної біофізики, фізики і хімії». Тезисы докладов БФФХ-2010 (26-30 апреля 2010 г.), T.1, Севастополь.– С.201-204.
16. Кушелев А.Ю., Полищук С.Е., Неделько Е.В. и др. Построение масштабной модели структуры белка // Актуальные проблемы современной науки. – 2002. – №2. – С. 236-243
17. Кушелев А., Полищук С., Писаржевский С. Формы, механизмы, энергия наномира: Доступна ли энергия эфира для космических полётов? // Электроника: Наука, Технология, Бизнес. – 2002. – № 6. – С.72–76.
Принимаются предложения по распространению электронного тиража учебника "Пикотехнология белков" и перевод на английский язык для распространения учебника среди англоязычных читателей.
















